المجموعات والتوزيع الإلكتروني
فهم كيف تنظم العناصر في الجدول الدوري وسر التوزيع الإلكتروني
لماذا ننظم العناصر في جدول؟
تخيل مكتبة ضخمة بدون ترتيب! سيكون من الصعب جداً إيجاد الكتاب الذي تريده. الجدول الدوري يشبه مكتبة العناصر، حيث ننظمها ليسهل علينا فهمها.
نضع العناصر التي تتشابه في صفاتها وسلوكها الكيميائي في مجموعات (الأعمدة الرأسية). هذا يساعدنا على توقع كيف ستتصرف العناصر المختلفة. يعتمد هذا الترتيب بشكل كبير على شيء مهم يسمى التوزيع الإلكتروني.
نضع العناصر التي تتشابه في صفاتها وسلوكها الكيميائي في مجموعات (الأعمدة الرأسية). هذا يساعدنا على توقع كيف ستتصرف العناصر المختلفة. يعتمد هذا الترتيب بشكل كبير على شيء مهم يسمى التوزيع الإلكتروني.
سر الذرات: التوزيع الإلكتروني
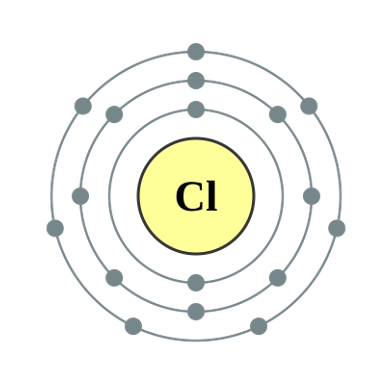
التوزيع الإلكتروني هو طريقة لوصف كيف تتوزع الإلكترونات الصغيرة حول نواة الذرة، مثل الكواكب تدور حول الشمس في مدارات (نسميها هنا مستويات الطاقة).
عدد الإلكترونات في المستوى الخارجي هو الأهم! هو الذي يحدد كيف يتصرف العنصر: هل هو نشيط ويتفاعل بسهولة؟ أم هو مستقر وخامل؟
عدد الإلكترونات في المستوى الخارجي هو الأهم! هو الذي يحدد كيف يتصرف العنصر: هل هو نشيط ويتفاعل بسهولة؟ أم هو مستقر وخامل؟
- الفلزات القلوية (مجموعة 1): لديها إلكترون واحد فقط في المستوى الخارجي. تتخلى عنه بسهولة لتصبح مستقرة، لذا هي نشيطة جداً (مثل الليثيوم والصوديوم). يزداد نشاطها كلما نزلنا لأسفل في المجموعة.
- الهالوجينات (مجموعة 17): لديها 7 إلكترونات في المستوى الخارجي. تحتاج إلكترون واحد فقط لتكمل مستواها الخارجي وتستقر، لذا هي أيضاً نشيطة وتميل لاكتساب إلكترون (مثل الفلور والكلور). يزداد نشاطها كلما صعدنا لأعلى في المجموعة.
- الغازات النبيلة (مجموعة 18): مستواها الخارجي ممتلئ ومستقر (عادة 8 إلكترونات، أو 2 للهيليوم). لا تحتاج لفقد أو اكتساب إلكترونات، لذا هي خاملة جداً ونادراً ما تتفاعل (مثل الهيليوم والنيون).
ملخص سريع لأهم المجموعات
هذا الجدول يلخص لك أهم المعلومات عن المجموعات التي ركزنا عليها:
| المجموعة | أمثلة مشهورة | إلكترونات المستوى الخارجي | صفتها المميزة |
|---|---|---|---|
| 1 | ليثيوم (Li)، صوديوم (Na) | 1 إلكترون | فلزات قلوية (نشيطة جداً، تفقد إلكترون) |
| 17 | فلور (F)، كلور (Cl) | 7 إلكترونات | هالوجينات (نشيطة، تكتسب إلكترون) |
| 18 | هيليوم (He)، نيون (Ne) | 8 إلكترونات (أو 2 لـ He) | غازات نبيلة (خاملة، مستقرة) |
لعبة التحدي: خمن المجموعة!
إذا عرفت عدد الإلكترونات في المستوى الخارجي، يمكنك تخمين رقم مجموعته! جرب بنفسك:
اختر في ذهنك عدد إلكترونات المستوى الخارجي وتوقع مجموعته، ثم اضغط الزر المطلوب لتشاهد الحل:

ماذا تعلمنا اليوم؟
لقد اكتشفنا أن الجدول الدوري منظم بذكاء! العناصر في نفس المجموعة تتشابه لأن لديها نفس العدد من الإلكترونات في مستواها الخارجي.
فهم التوزيع الإلكتروني يساعدنا على توقع كيف ستتصرف العناصر، هل ستكون نشيطة مثل الصوديوم أم خاملة مثل النيون. هذا هو مفتاح فهم الكثير من التفاعلات الكيميائية حولنا!
فهم التوزيع الإلكتروني يساعدنا على توقع كيف ستتصرف العناصر، هل ستكون نشيطة مثل الصوديوم أم خاملة مثل النيون. هذا هو مفتاح فهم الكثير من التفاعلات الكيميائية حولنا!

